Introduction
Cette étude s’inscrit dans la continuité des travaux menés par M. Glémarec et J. Grall, publiés en 2003 dans Les Cahiers Nantais, s’intéressant à l’évolution spatiale des peuplements benthiques qui se sont succédés dans la baie de Concarneau (Bretagne Sud) de 1964 jusqu’à la fin des années 90 (Glémarec et Grall, 2003).
Dans cet article, nous utiliserons le terme « peuplement » pour désigner l’ensemble des populations d’un même niveau taxonomique (genre ou espèce) qui occupe le même biotope et qui crée une entité relativement stable et ho-mogène (Forêt, 2012). De la même façon le terme « benthique » qualifie les organismes aquatiques vivant à proximité du fond (fixés ou près du substrat) des mers, des océans, des lacs et des cours d’eau (Forêt, 2012).
En 1964, ces peuplements benthiques se répartissaient d’ouest en est selon un gradient granulométrique. En effet, le peuplement à Amphiura filiformis (ophiures) identifié sur du sable fin à l’ouest laissait place au peuplement à Maldane glebifex (annélides polychètes) sur des vases sableuses à l’est. Au centre de la baie de Concarneau, dans la vasière, entre la pointe de Trévignon et les Glénan, une population de Haploops sp. (amphipodes crustacés) formait une enclave au sein du peuplement à Maldane glebifex.
Les Haploops sont des petits crustacés amphipodes (fig. 1), de un à deux centimètres de long selon l’espèce (Dauvin et Bellan-Santini, 1990), qui appartiennent à la famille des Ampeliscidés (Krøyer, 1842).
Jusqu’à récemment les espèces du genre Haploops présentes en Bretagne Sud étaient considérées comme appartenant à Haploops tubicola. Cependant, après la description d’une nouvelle espèce, par R. Kaim-Malka en 1976, les collections ont été réexaminées et des analyses génétiques ont été effectuées. Les individus de la baie de Concarneau ont été attribués à l’espèce Haploops nirae (fig. 1), par J.-C. Dauvin et D. Bellan-Santini (1990) et confirmés par C. Rigolet (2013). Cette espèce, comme la plupart des Ampeliscidés, est tubicole. Chaque individu vit dans son propre tube, qui ne peut être ouvert que de l’intérieur (Dauvin et Bellan-Santini, 1990). Les tubes de Haploops nirae sont positionnés verticalement et possèdent une forme aplatie ressemblant à une cosse de légumineuse (fig. 1). Chez les individus adultes, ils peuvent atteindre cinq centimètres de long et dépasser de deux à trois centimètres de la surface du sédiment (fig. 1). Pour se nourrir, les Haploops se tiennent en position dorsale près de l’orifice du tube et filtrent le phytoplancton environnant en balayant la colonne d’eau avec leurs antennes (Rigolet et al., 2011).
Les densités de Haploops étaient d’environ de 2 000 à 5 000 individus par mètre carré en 1964 (Glémarec et Grall, 2003). Dix ans plus tard, les populations de Haploops avaient colonisé, vers le nord, une grande partie des vases à Maldane glebifex (Ménesguen, 1980). En effet, les tubes de vase compacte construits par les Maldane glebifex sont larges et favorisent le recrutement des juvéniles (Glémarec et Grall, 2003). Au contraire, au nord-ouest, la forte bioturbation engendrée par l’activité alimentaire de Amphiura filiformi déstabilise la couche sédimentaire superficielle et empêche ainsi le recrutement des juvéniles de Haploops (Glémarec et al., 1987).
Or, lors d’une campagne de suivi de la surveillance des peuplements macrobenthiques sur les côtes bretonnes (REseau BENThique) en 2003, un champ de pockmarks a été mis en évidence dans la baie de Concarneau (Ehrhold et al., 2006). Les pockmarks sont des dépressions sédimentaires de forme généralement circulaire et de diamètres variés (de quelques mètres à quelques centaines de mètres) pour des profondeurs variant de quelques décimètres à plusieurs dizaines de mètres. Ils correspondent à des figures d’échappement de gaz et fluides (Hovland et al., 2002) et se forment dans des sédiments fins (vase). Ils existent aussi bien en domaine profond (Hovland et Judd, 1988) qu’en domaine côtier (Fleisher et al., 2001).
Suite à cette découverte, M. Glémarec et J. Grall (2003) suggèrent que l’activité des pockmarks pourrait être « une cause de la mortalité brutale des Haploops », fragilisant ainsi l’équilibre sédimentaire de la baie. En effet la disparition de cette faune spécifique, construisant de véritables tapis de tubes sur le fond, entrainerait « une brutale érosion de la vasière ».
Aujourd’hui, dans la baie de Concarneau, le peuplement à Haploops forme des tapis de tubes d’une rare densité, allant de 6 800 à 25 550 individus par mètre carré (Rigolet et al., 2012) et les pockmarks présentent des densités remarquables pouvant atteindre 2 500 pockmarks par kilomètre carré (Souron, 2009 ; Baltzer et al., 2014).
Le travail présenté ici, basé sur les données de plusieurs campagnes s’échelonnant de 2003 à 2014, propose de nouvelles hypothèses quant aux liens existant entre les pockmarks et le peuplement à Haploops nirae dans la baie de Concarneau.
Matériels et méthodes
Acquisition des données
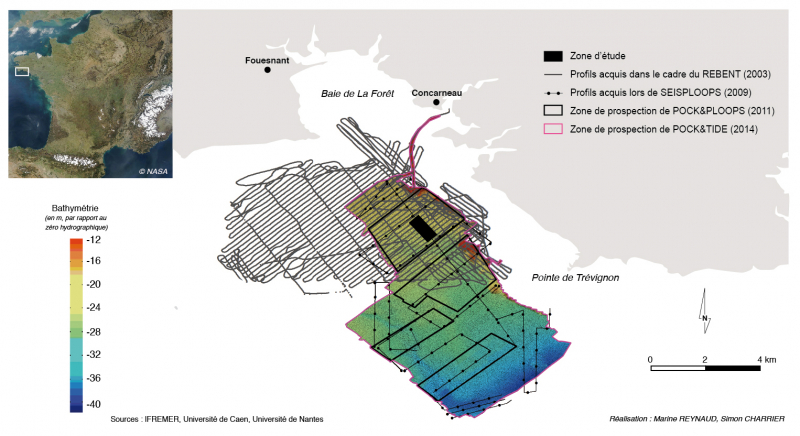
Les données utilisées dans cette étude proviennent de quatre campagnes en mer (fig. 2) :
- La campagne REBENT (REseau BENThique) de mars 2003 a permis de mettre en évidence la présence de pockmarks dans la baie de Concarneau grâce à l’utilisation du sonar à balayage latéral (Edgetech DF1000). Cet outil, constitué d’un « poisson » et tracté à une vitesse de cinq nœuds derrière le navire océanographique (N/O) Thalia (Génavir), a permis la réalisation d’une mosaïque d’imagerie sonar (compilation de 92 profils d’imagerie) dans la partie Nord de la baie de Concarneau.
- La campagne SEISPLOOPS (SEIStec-haPLOOPS), réalisée en avril 2009 à bord du N/O Le Côte d’Aquitaine (INSU), a permis l’obtention de 26 profils d’imagerie sonar à balayage latéral (Edgetech 270TD analogique) et de 33 profils sismiques très haute résolution (Boomer Seistec).
- La campagne POCK&PLOOPS (POCKmarks et haPLOOPS), réalisée en avril 2011 à bord de la vedette océanographique (V/O) Haliotis (Génavir), a permis l’acquisition de profils acoustiques sur quatre zones non jointives (fig. 2). L’Haliotis est équipé d’un sonar interférométrique (GeoAcoustics GeoSwath, 250 kHz) et d’un sondeur à sédiment (1,8 à 5,3 kHz) fixés sous la coque. Au total 96 profils ont été obtenus, avec l’acquisition simultanée de la bathymétrie, de l’imagerie sonar et des données du sondeur à sédiment le long de chaque profil.
- La campagne POCK&TIDE (POCK-marks et TIDE), programmée en avril 2014 à bord de la V/O Haliotis, a permis de compléter le jeu de données de 2011 avec l’acquisition de 205 profils supplémentaires et de réaliser le suivi des différentes zones.
Figure 2 – carte de répartition des différents profils (imagerie sonar et bathymétrie) acquis lors des quatre campagnes en mer
Traitement des données
Les analyses des images sonar acquises en 2003, 2011 et 2014 ont permis de cartographier la répartition des pockmarks et du peuplement à Haploops nirae. Les données ont été traitées avec le logiciel IsisSonar® (développé par TritonElics) pour celles de 2003 et avec le logiciel GeoTexture® (développé par Geoacoustic) pour celles de 2011 et 2014. Ces logiciels génèrent des mosaïques sonar géoréférencées qui sont ensuite exportées et interprétées sous ArcGis® 9.3 (développé par Esri).
Cependant, l’imagerie de 2011, de trop mauvaise qualité pour des raisons météorologiques, n’a pu être utilisée pour cette étude.
La bathymétrie a été traitée à l’aide du logiciel Caraïbes® 4.0 (développé par l’Ifremer). Les corrections des hauteurs de marée ont été effectuées grâce aux données d’un marégraphe, mouillé dans la zone durant les travaux à la mer afin de réaliser des cartes bathymétriques précises (0,5 mètre).
Ces données présentent également un géoréférencement de précision centimétrique, rendu possible grâce aux informations du GPS Verseau Thalès couplées à celles de la balise RTK installée sur la côte pour la mission. Le positionnement centimétrique des données justifie la pertinence et la validité d’un suivi sur l’évolution spatio-temporelle de l’association Haploops et pockmarks dans la zone étudiée.
Le pointage des pockmarks a été réalisé manuellement avec ArcGis® 9.3 sur l’ensemble des données acoustiques (bathymétrie et imagerie sonar) de 2003 et 2011 par les étudiants du Master 1 Géographie, option espace et géomatique (promotion de 2013/2014), ce qui a permis d’établir une cartographie précise de leur répartition.
Résultats et observations
Aire de répartition des pockmarks et du peuplement à Haploops nirae
La combinaison des données de bathymétrie et d’imagerie sonar permet de cartographier aussi bien les pockmarks que les Haploops. En effet, les images sonar présentent des nuances de gris en fonction des variations de la morphologie, de la nature et de la compaction des sédiments. L’activité de bioconstruction des Haploops modifie non seulement la nature du fond mais également la compaction des sédiments : les particules fines sont piégées par les tapis de tubes ce qui entraine un exhaussement du fond. Ainsi les populations de Haploops nirae apparaissent en taches plus sombres sur les images sonar (fig. 1).
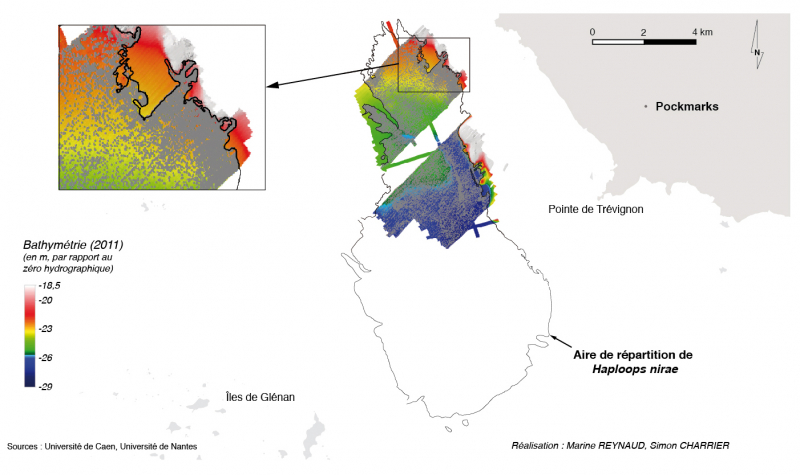
En 2011/2014, la mosaïque sonar montre que l’aire de répartition des Haploops couvre une surface de 38,5 kilomètres carrés (fig. 3). Elle est allongée selon une direction nord-sud avec une extremité sud plus évasée. Ses limites nord et sud se situent aux latitudes 47°49’48’’N et 47°43’35’’N respectivement et ses limites ouest et est se situent au longitudes -3°56’45’’O et -3°52’O respectivement.
40 937 pockmarks ont été pointés et les données acoustiques nous montrent que l’aire de répartition de ces pockmarks coïncide exactement avec celle des Haploops (fig. 3).
Les pockmarks de la baie de Concarneau présentent ainsi des densités remarquables pouvant atteindre 2 500 pockmarks par kilomètre carré. Leur mécanisme de formation est lié à l’environnement géologique et plus précisément au remplissage sédimentaire du réseau de paléovallées oligocènes creusées dans le socle cristallin (Menier, 2003 ; Baltzer et al., 2014). En effet, au cours de la dernière remontée du niveau marin à l’Holocène, les sédiments riches en matières organiques ont été enfouis sous les sédiments accumulés dans les lits des paléovallées et ont ainsi été préservés de l’oxydation. Puis, la dégradation de la matière organique a produit du gaz, essentiellement du méthane biogénique, qui tend à migrer vers le haut de la colonne sédimentaire (Ehrhold et al., 2007 ; Baltzer et al., 2014). Ces travaux ont permis de différencier deux groupes de pockmarks. Le premier groupe est caractérisé par un diamètre inférieur à 10 mètres et a une origine liée à un remplissage sédimentaire peu profond (inférieur à deux mètres de profondeur). Le second groupe possède un diamètre compris entre 10 et 30 mètres et correspond à un remplissage plus profond (six mètres environ), caractéristique de celui des paléovallées de l’Oligocène supérieur (Baltzer et al., 2014).
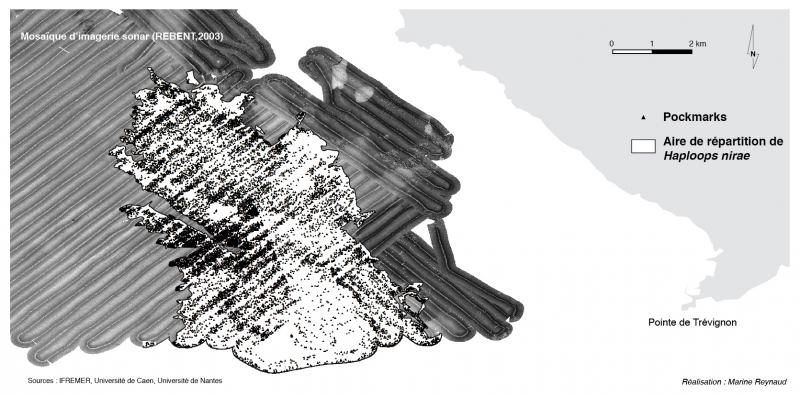
Les données d’imagerie sonar de 2003, les plus anciennes en notre possession, ne permettent pas de localiser l’ensemble du peuplement à Haploops nirae ni de délimiter le champ de pockmarks dans sa globalité. Cependant le dénombrement de 13 335 pockmarks, localisés au sein de la zone colonisée par ces amphipodes, confirme l’existence d’une relation étroite entre ces deux entités (fig. 4).
L’étape suivante consiste à comprendre la temporalité des pockmarks : la pérennité (ou non) de l’emplacement de ces cratères et de leur taux d’activité. Pour ce faire, nous avons choisi une zone caractéristique et facile à reconnaître sur plusieurs années d’intervalle.
Évolution des pockmarks de 2003 à 2014
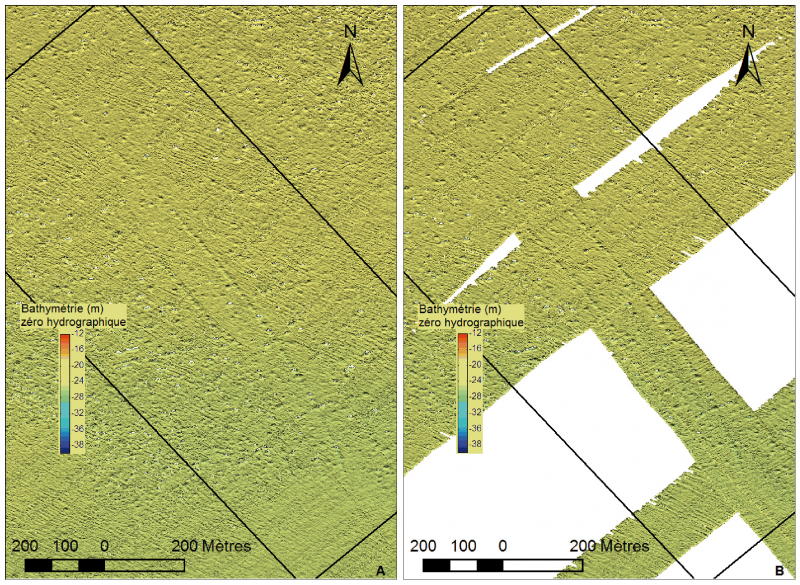
L’évolution spatio-temporelle du champ de pockmarks a donc été étudiée sur une zone ayant une surface de 0,70 kilomètre carré (fig. 2), située au nord de l’aire de répartition des Haploops, à une profondeur comprise entre 19 et 25 mètres. Deux alignements parallèles de pockmarks de direction nord-ouest/sud-est sont clairement visibles sur la bathymétrie de 2011 (fig. 5A) et de 2014 (fig. 5B). Cette disposition originale est aussi facilement reconnaissable en imagerie. Ces alignements correspondent à des traces laissées par des activités de pêches aux arts trainants (panneaux de chalut). Notre hypothèse est que la formation de ces pockmarks est engendrée par l’action des panneaux de chalut qui déstabilise la couche sédimentaire superficielle et permet d’évacuer la surpression interstitielle due à la présence des gaz et fluides contenus dans les trois premiers mètres de la colonne sédimentaire. L’expulsion de ces gaz et fluides se matérialise alors sous la forme de chapelets de cratères de dégazage le long du sillon de chaque panneau (Baltzer et al., 2014).
Figure 5 – carte bathymétrique de la zone d’étude en 2011 (A) et 2014 (B) mettant en évidence les pockmarks dans les traces de chalut
Il est remarquable de constater que ces traces de chalutage, déjà présentes en 2003 (fig. 6A) et 2009 (fig. 6B) sont toujours visibles en 2014 et que l’on retrouve les pockmarks aux mêmes emplacements.
La figure 6 montre la zone d’étude choisie pour tenter de répondre à la question du taux d’activité des pockmarks. La première observation est que le nombre de pockmarks ne semble pas avoir changé entre 2003 et 2014. La seconde observation est que dans la majorité des cas, les pockmarks présents dans la zone en 2003 (fig. 6A) et en 2009 (fig. 6B) apparaissent comme des taches blanches au lieu de taches de faciès sombres correspondant aux dépressions des cratères de dégazage. Ce faciès clair traduit la présence de sédiments fins (type vases) qui napperaient le fonds des pockmarks ou les combleraient. La bathymétrie permet de se prononcer pour l’une ou l’autre de ces hypothèses.
En 2014 par contre, l’imagerie sonar (qui apparait très lumineuse après traitement, fig. 6C) révèle un faciès gris plus foncé pour la plupart des cratères et montre que leur forme semble, en général plus circulaire (fig. 6C). Ces deux observations suggèrent que le remplissage de sédiments fins (traduit par un faciès sonar clair) a soit été érodé, soit été expulsé, engendrant des pockmarks plus profonds et creusés en 2014 qu’en 2003 et 2009. La comparaison des bathymétries de 2011 (fig. 5A) et de 2014 (fig. 5B) confirme également ce changement des formes des cratères de dégazage.
L’érosion et/ou l’agrandissement des pockmarks peuvent être les conséquences soit de processus internes tels que des expulsions de fluides, capables de remettre en suspension le remplissage sédimentaire (entre 2011 et 2014), soit de processus externes, associés à des évènements extrêmes tels que les grandes houles de tempêtes de l’hiver 2014, laissant des cratères dépourvus de sédiment.
Discussion
Le peuplement à Haploops nirae occupe actuellement une surface de 38,5 kilomètres carrés en baie de Concarneau. Ainsi de 1964 à 2003, son aire de répartition s’est étendue vers le nord de la baie (Ehrhold et al. 2006 ; Rigolet, 2013). En tenant compte de la capacité de propagation de Haploops nirae au cours des trente-neuf premières années d’études, la comparaison des mosaïques d’imagerie entre 2003 et 2014 montre que cette extension semble s’être stabilisée, ne dépassant pas les limites du champs de pockmarks (Reynaud, 2014).
La comparaison des mosaïques d’imagerie de 2003, 2009, 2011 et 2014 nous permet de constater une certaine pérennité de l’emplacement des pockmarks que l’on peut expliquer par différentes hypothèses.
La compaction et la consolidation de la vase dues à la présence des Haploops (Ehrhold et al., 2007) peuvent favoriser la préservation de figures sédimentaires telles que les pockmarks et les empreintes laissées par les activités anthropiques (trace de chalutage).
La dynamique et l’activité elle-même d’expulsion des pockmarks entretient la persistance de ces reliefs sous-marins.
A. Baltzer et al. (2014) suggèrent que ces cratères de dégazage seraient actifs de manière récurrente pour expliquer leur association avec le peuplement à Haploops. La marée est l’hypothèse envisagée comme paramètre déclencheur mais la fréquence et la durée de cette activité restent encore à découvrir.
En effet, le suivi effectué de 2003 à 2014 a montré que ces pockmarks semblent avoir des périodes d’inactivité favorables au remplissage des cratères par des particules fines et des périodes d’activité propices à l’érosion des parois et à l’agrandissement des cratères.
La succession de tempêtes qui a eu lieu entre la fin de l’année 2013 et le début 2014 pourrait avoir joué un rôle dans la déstabilisation du sédiment et par conséquent dans l’activation des pockmarks entre 2011 et avril 2014, et/ou dans l’altération de la couche fine de sédiment (le faciès blanc) présente dans les cratères de certains pockmarks.
Afin de répondre à ces interrogations, il faudrait préciser le processus de mise en place du faciès clair observé dans les pockmarks et son pas de temps. S’agit-il d’un remplissage de crème de vase temporaire (apport des marées) ou remplissage à plus long terme (annuelle) ?
L’acquisition de carottes et la mise en place d’un piège à particules permettraient d’apporter de nouveaux arguments et d’étayer l’une de ces hypothèses.
Cette association originale Haploops/pockmarks a également été observée en baie de Fundy, au Canada avec Haploops fundiensis (Wildish, 1984) et dans l’Øresund, détroit entre le Danemark et la Suède, avec Haploops tubicola et Haploops tenuis (Petersen, 1924). Dans chaque cas, des densités importantes de Haploops sont observées (de 500 à 10 000 individus par mètre carré) et sont associées à des pockmarks. Notons qu’une prospection de l’Øresund dans les années 1990 a mis en évidence une quasi-disparition du peuplement à Haploops en raison de l’eutrophisation (Göransson, 2002). Dans tous les cas cette cohabitation n’a pas fait l’objet d’une étude systématique. Plusieurs hypothèses ont été énoncées et restent encore à être explorées afin de comprendre cette association.
C. Rigolet (2013), dans ses travaux de thèse, a permis d’exclure l’hypothèse d’une chimiosynthèse ou de l’existence d’une bactérie symbiotique pour expliquer cette cohabitation.
A. Baltzer et al. (2014) proposent que l’activité des pockmarks, par libération de fluides et gaz, entraine une remise en suspension de particules sédimentaires propice au processus de nutrition de façon directe ou indirecte (Rigolet et al. 2014).
Enfin, M. Reynaud (2014) propose que l’expulsion des fluides faciliterait la construction des tubes de Haploops en leur fournissant un sédiment très fin et mieux trié.
L’expulsion des fluides pourrait également jouer un rôle dans le cycle de vie des Haploops puisque la reproduction et la dispersion des juvéniles s’effectuent dans la colonne d’eau.
Conclusion
Les résultats de cette étude ne permettent pas encore de définir précisément le type d’interaction existant entre les Haploops et les pockmarks. Cependant plusieurs hypothèses reliant l’activité des pockmarks au rôle de nourrissage ou de reproduction des Haploops pourraient être explorées en complétant les données actuelles avec des prélèvements sédimentaires et des mesures in situ.
L’évolution d’une telle association ne peut être mise en évidence que par un suivi régulier sur le long terme, qui offre la possibilité d’envisager les changements que subit l’environnement et de comprendre les interactions entre un habitat et la faune qu’il héberge.
La compréhension de cette association est primordiale dans la préservation de cet écosystème et de la conservation d’espèces d’intérêts particuliers, rares ou d’intérêt commercial, qui vivent en son sein.
Les auteurs souhaitent remercier toute l’équipe présente lors de la réalisation et du traitement des données acquises lors des différentes campagnes ; Axel EHRHOLD, Jérôme FOURNIER, Céline CORDIER ainsi que l’équipage de la V/O Haliotis, Arnaud GILLIER, Jacques LE DOARÉ et Renaud CAGNA.